El átomo
Que se sabía
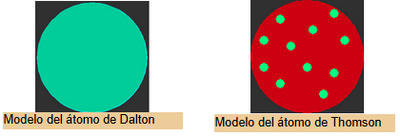
En el año 1808 Daltón publicó su famosa teoría del modelo atómico de la materia, donde expresaba que la materia estaba formada por partículas esféricas pequeñas e indivisibles llamadas átomos, y que existían distintas clases de átomos que se clasificaban por su masa y sus propiedades.
Sin embargo, la idea de que la materia se componía de partículas pequeñísimas e indivibles no era nueva, ya había sido sostenida por Demócrito unos 400 años antes de Cristo, quien había llamado a estas pequeñísimas partículas átomos, que en griego significa indivible. Lamentablemente, las ideas de Demócrito no fueron aceptadas en su época y hubo que experar más de 2000 años para salieran nuevamente a la luz. Para mediados del siglo XIX ya existían además indicios de que el átomo no era indivible y que en realidad estaba compuesto de partículas de menor tamaño.
En el año 1869 Dmitri Mendeleiev, profesor de Química de la Universidad de San Petersburgo, Rusia, y Julius Meyer, químico aleman y profesor de Ciencias naturales en Eberswalde, trabajando por separado, propusieron un ordenamiento de los 64 elementos químicos conocidos en ese entonces que se denominó tabla períodica de elementos, la que ya para fines del siglo XIX era considera seriamente por los químicos, quienes ya conocían bastante sobre los átomos.
Sin embargo, en ese momento no eran muchos los físicos que creían en ellos. La razón se debía a que muchos aspectos del comportamiento de la naturaleza, como los estados de la materia, podian ser explicados en forma satisfactoria mediante el comportamiento de las moléculas, por el contrario con los átomos ninguna teoría parecía tener éxito. Parecía que el comportamiento de éstos no podía ser descripto por las leyes conocidas de la física ni tampoco se veía la forma de diseñar nuevas leyes que lo describieran adecuadamente y por esta razón se los dejaba de lado.
Pero una serie de experimentos con resultados inexplicables y la consecuente curiosidad que despertaron dieron impulso a nuevas investigaciones...
Descubrimiento del electrón El descubrimiento de los rayos X por Röntgen impulsó a J.J. Thomson a utilizarlos para estudiar la ionización de los gases, descubriendo que los rayos X volvían conductor al aire que atravesaban. Thomson encontró que los rayos podían extraer de las moléculas del gas una partícula minúscula, cargada negativamente, a la que llamó corpúsculo (electrón). Si bien la existencia del electrón habia sido postulada por G. Stoney, Thomson descubrió que se trataba de una partícula elemental (1897) y pudo medir el cociente entre la carga y la masa del electrón. Posteriormente, en 1909, Millikan, en un célebre experimento realizado en colaboración con Fletcher mide la carga del electrón. Esta tiene un valor [math]\displaystyle{ e =1,6\times 10^{-19}Coulombs }[/math]. El valor de la masa del electrón es [math]\displaystyle{ m_e =9,1\times 10^{-31}Kg }[/math].
Modelo de Thomson Como resultado de sus experimentos J.J. Thomson comprobó que el átomo no era indivisible y propuso entonces un nuevo modelo de átomo que se conoció como átomo de Thomson y se popularizó como moledo del budin con pasas
El modelo consistía en una esfera con una distribución uniforme de carga positiva y los electrones cargados negativamente inmersos en ella. Esta visión del átomo se mantuvo por alrededor de una década hasta que los experimentos de Rhutherford, que descubrieron la existencia del núcleo atómico, demostraron que era errónea
Experimento de Rutherford, Geiger y Marsden
Al bombardear láminas de oro con partículas alfa (núcleos de Helio) vieron que algunas de ellas eran
desviadas con respecto a la dirección de incidencia en más de 90 grados, (como si la partícula alfa
rebotara contra la lámina). Este resultado sólo podía explicarse si la distribución de carga en el átomo era distinta a la supuesta en el modelo del átomo
de J.J. Thomson.
Cabe mencionar que ya en 1886, Eugene Goldstein había realizado experimentos observando rayos catódicos compuestos de iones cargados positivamente, y que con posterioridad al descubrimiento del electrón, por J.J. Thomson, Goldstein sugirió que el átomo debía contener partículas cargadas positivamente, dado que era eléctricamente neutro.
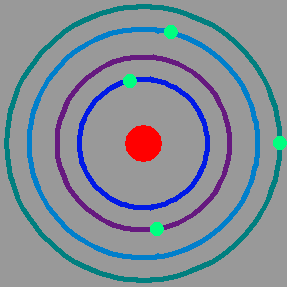
Modelo de Rutherford En 1911 Rutherford publica un trabajo donde postula un modelo revolucionario del átomo. El nuevo modelo describe al átomo como un sistema solar en miniatura donde el núcleo, cargado positivamente, ocupa una muy pequeña fracción del volumen total del átomo representando al sol y los electrones a los planetas. Los electrones están orbitando en torno al núcleo y ligados a el por la atracción electrostática.
Este nuevo modelo era capaz de explicar la causa de los rebotes de las partículas alfa al chocar contra las láminas de oro, estos eran el resultado de los choques de las partículas alfa contra los núcleos de oro.
Tamaño del núcleo
Veamos un ejemplo: en el átomo de oro el radio atómico es 18.000 veces mayor que el tamaño del núcleo. Si lo comparecemos con el sistema solar, en una escala en la que el sol y el núcleo fueran del mismo tamaño, esto significaría que el electrón más externo, o sea el que está más lejos del
núcleo, dista de este el doble de la distancia que hay entre Plutón y el Sol!!
El núcleo además en un espacio tan pequeño concentra la mayor parte de la masa
del átomo.
Sin embargo, si este modelo era correcto ¿Cómo se podía explicar la estabilidad de la materia? ya que se sabía que cuando una partícula cargada (el electrón) es acelerada emite radiación electromagnética y al hacerlo pierde energía, de forma tal que la órbita del electrón se reduciría cada vez más hasta que finalmente ¡chocaría contra el núcleo!
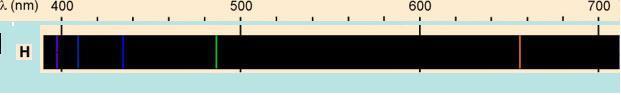
Para esa fecha el Hidrógeno había sido muy estudiado y se conocía que cuando absorbía energía electromagnética emitía radiación en forma de 5 lineas que eran visibles. Este era otro aspecto que el modelo de Rutherford no podia explicar. Había que pensar entonces en un nuevo modelo.....
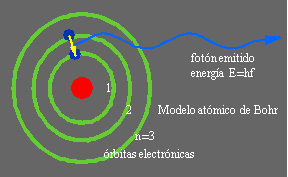
Modelo atómico de Bohr Sobre la base de modelo de Rutherford, pero incorporando además las ideas de cuantificación de la materia propuestas por Einstein y por Planck, Bohr propuso en 1913 un nuevo modelo del átomo que era capaz de explicar la estabilidad de la materia y el espectro de emisión del átomo de Hidrógeno. En este modelo los electrones ocupaban órbitas específicas, identificadas con un número n y con una energía cuantizada determinada. Al pasar de un nivel electrónico a otro de menor (mayor) energía el electrón emite (absorbe) radiación electromagnética mediante un fotón con energía E=hf siendo esta cantidad igual a la diferencia de energías entre los dos niveles. La letra h identifica a la famosa constante de Planck, que es la unidad de medida del mundo microscópico, siendo su valor: [math]\displaystyle{ h=6,63\times 10^{-34} J.s }[/math]. La letra f representa la frecuencia de la radiación emitida. Este modelo, si bien describía correctamente el átomo de Hidrógeno, fue posteriormente dejado de lado al no poder explicar el espectro de átomos más complejos, pero jugó un papel clave en el desarrollo de la Mecánica Cuántica actual.
¿Cómo se compone el núcleo?
El protón Para 1920 Rutherford y sus colaboradores habian realizado numerosas experiencias encontrando que la carga positiva de cualquier núcleo era un número entero de veces la carga del núcleo del átomo de Hidrógeno, que comenzó a denominarse con el nombre de protón.
El neutrón En 1932 Chadwick confirma la existencia del neutrón, partícula sin carga, y con una masa similar a la del protón que se encuentra en el núcleo átomico. La masa del neutrón es [math]\displaystyle{ m_n =1,675\times 10^{-27}Kg }[/math]. La existencia del neutrón habia sido anticipada por el mismo Rutherford. Es decir que en el año 1932 se sabía con certeza que el núcleo atómico está formado por protones y neutrones.
Pero... ¿Termina la historia aqui? ¿O será que el neutrón y el protón, se componen a su vez de otras partículas?
Para responder a estos interrogantes tienen ahora la palabra la Mecánica Cuántica y la Física de las partículas elementales.
Debug data: